Pada pembahasan kali ini pengajar.co.id akan menciptakan artikel yang berjudul Teori Atom Rutherford, yuk sama-sama kita simak dibawah ini :
Pengertian Atom
Atom merpuakan sebuah satuan dasar bahan, yang terdiri dari inti atom serta awan elektron yang bermuatan negatif yang mau mengelilinginya. Inti atom berisikan proton yang bermuatan positif, atau juga neutron yang bermuatan netral.
Elektron-elektron pada sebuah atom ini mampu terikat pada inti atom oleh gaya elektromagnetik.dari beberapa Sekumpulan atom demikian pula dapat berikatan satu sama lainnya, dan juga dapat membentuk suatu molekul. Atom yang mengandung jumlah proton dan elektron yang serupa bersifat netral,kemudian sedangkan yang mengandung jumlah proton atau elektron yang berlawanan bersifat nyata maupun negatif sering disebut selaku ion. Atom juga dikelompokkan berdasarkan jumlah proton dan neutron yang terdapat pada inti atom tersebut. Jumlah proton pada atom ini akan menentukan unsur kimia atom tersebut, dan jumlah neutron memilih isotop unsur tertentu.
Dasar Teori Atom Ernerst Rutherford
Setelah Teori Atom Jhon Dalton disanggah dan juga diperbaiki oleh Jj. Thomson ini menyatakan bahwa atom itu seperti Roti Kismis,yang Selanjutnya giliran Rutherford yang mampu menyangkal kebenaran teori atom Thomsom.
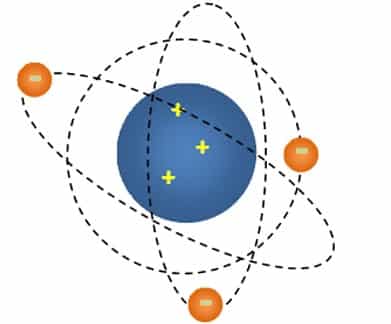
Yang ketika itu Rutherford menyampaikan bahwa atom meiliki suatu inti sentra atau sering disebut nekleus dengan dikelilingi awan elektron bermuatan negatif.
Teori atom Rutherford didasarkan pada eksperimen penembakan inti atom lempengan emas pada partikel alfa yang sering diketahui dengan percobaan Geiger-Marsden. pada watu itu, Rutherford ini akan menyusun rancangan rancangan percobaan penembakan atom emas oleh partikel alfa yang sudah dipancarkan oleh unsur radio aktif.nah Ternyata, sinar radio aktif tersebut ada yang sudah dipantulkan, dibelokkan, maupun diteruskan. Rutherford ini lalu menjelaskan bahwa jika partikel alfa mengenai inti atom, maka akan terjadi tumbukan yang menyebapkan pembelokan maupun juga pemantulan partikel alfa. Hal tersebut ini disebabkan alasannya massa dan juga muatan atom yang terpusat pada inti nukleus. Rutherford ini kemudian menyarankan bahwa muatan inti atom akan seimbang dengan massa atom dalam SMA /satuan kala atom. Partikel alfa yang perihal awan elektron tidak akan dibelokkan maupun dipantulkan.
Dari hasil pemahamannya melaui eksperimennya tersebut, Ernerst Rutherfordutherford jadinya menyimpulkan dan menyatakan bahwa:
• Sebagian besar volume atom merupakan ruang hampa tertentu.
• Massa atom ini akan terpusat pada inti atom (nukleus).
• Muatan atom mampu terkonsentrasi pada sentra atom dengan volume yang tidak mengecewakan kecil. Kelipatan muatan tersebut sepadan dengan massa atom.
Melalui pernyataannya E. Rutherford ini dapat menyangkal bahwa atom bukanlah seperti roti kismis melainkan juga mirip susunan planet yang mengorbit matahari. Yang dimana matahari ini akan diumpamakan sebagai inti sentra yg bermuatan nyata (nukleus) atau juga susunan planet yang diumpakanya sebagai muatan negatif,oleh sebab itu, teori atom Dalton dan juga Thomson yang memiliki keunggulan ataupun kelemahannya, Teori atom E. Rutherford juga mempunyai keunggulan dan kelemahannya. Dibawah ini yaitu kelebihan dan kelemahan dari teori atom E. Rutherford
Kelebihan Teori Atom Ernerst Rutherford
• Praktis dipahami untuk bisa menerangkan struktur atom yang sungguh rumit
• Bisa menjelaskan bentuk dari lintasan elektron yang mengelilingi inti atom
• Dapat menggambarkan gerak elektron disekitar inti
Kekurangan Teori Atom Ernerst Rutherford
• Model atom rutherford ini belum bisa menjelaskan dimana letak elektron dan juga cara rotasinya kepada ini atom.
• Elektron ini bisa memancarkan energi dikala bergerak,kemudian sehingga energi atom menjadi tidak stabil.
• tidak mampu menjelaskan spektrum garis pada atom hidrogen (H).
Bunyi Teori Atom Rutherford
Rutherford meneliti pencerai-beraian ‘ sinar (Alfa) pada pelat emas. Hasil yang diamati dikembangkan dalam hipotesis model atom Rutherford: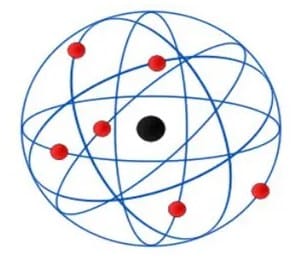
- Sebagian besar atom adalah permukaan kosong atau berongga.
- Atom mempunyai inti atom bermuatan konkret, yang ialah sentra massa atom.
- Elektron bergerak di sekeliling inti pada kecepatan yang sungguh tinggi.
- Sebagian besar partikel berlalu tanpa hambatan/kendala. Sebagian kecil bengkok, dan sungguh sedikit yang tercermin.
- Awan elektron tidak mensugesti penyebaran partikel alfa.
Model Teori Atom Rutherford
Rutherford mempresentasikan model fizikal dari struktur subatomik sebagai tafsiran hasil percobaan tak terduga. Ini membangun versi atom yang mirip dengan tata cara tata surya. Dalam penyajian ini, atom berisikan sebuah sentra massa (yang lalu disebut selaku inti, meskipun Rutherford tidak memakai ungkapan “inti” dalam tindakannya) dan dikelilingi oleh awan (diduga) selaku elektron berputar.
Ada beberapa indikator kunci dalam hipotesis model atom Rutherford, termasuk:
- Awan elektron tidak mempunyai dampak pada hamburan partikel alfa.
- Banyak muatan positif dari atom berfokus pada volume kecil di atom pusat, yang lalu diketahui sebagai nukleus. Tingginya muatan seimbang dengan massa atom — massa yang tersisa dikenali sangat dipengaruhi oleh neutron…. Pusat massa dan muatan terfokus ini kuat pada pantulan partikel alfa dan beta.
- Massa atom berat mirip emas lazimnya berfokus pada kisaran muatan, alasannya perhitungan menawarkan bahwa permukaan tidak tercermin atau digerakkan oleh adanya partikel alfa berkecepatan tinggi, yang mempunyai denyut nadi sungguh tinggi daripada elektron, tetapi tidak mewakili atom seluruh berat.
- Atom itu sendiri mempunyai diameter 100.000 (105) kali lebih besar ketimbang diameter nukleus. Representasi dapat diasumsikan seolah-olah Anda menempatkan butiran pasir di tengah lapangan sepak bola.
Dalam kasusnya pada Mei 1911, Rutherford berfokus secara langsung pada area pusat yang sungguh tinggi muatan faktual atau negatif dalam atom.
Demikianlah artikel perihal Teori Atom Rutherford : Pengertian, Dasar, Kelebihan, Kekurangan, Bunyi, Model dari pengajar.co.id biar berfaedah.
